下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)= c(NH )=c(Cl-) )=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c (HCOO-)+ c(H+)>c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) |
在由NaOH、Na2O2组成的化合物中钠元素的质量分数为58%,则混合物中氢元素的质量分数近似为()
| A.6% | B.2% | C.4% | D.无法确定 |
实验室常用氢氧化钠溶液吸收氯化氢尾气,以防止环境污染。下列既能吸收尾气,又能防止溶液倒吸的装置是()
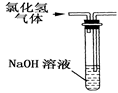


A B C D
下列离子方程式书写正确的是 ()
| A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- =Al(OH)3↓ |
C.三氯化铁溶液中加入铁粉: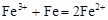 |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是()
| A.转移溶液后未洗涤烧杯和玻璃棒就直接定容 |
| B.移液前容量瓶中有少量蒸馏水 |
| C.在容量瓶中进行定容时俯视刻度线 |
| D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
只用试管和胶头滴管而不用其它试剂无法区分的一组溶液是()
| A.KOH溶液和AlCl3溶液 | B.Na2CO3溶液和盐酸 |
| C.MgCl2溶液和氨水 | D.盐酸和NaAlO2溶液 |