氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
| A.由反应可确定:氧化性HClO3>O2 |
| B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期, D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是()
A.原子半径:D>B>E>C>A
B.单质D可用海水作原料获得
C.热稳定性:EA4>A2C
D.化合物DC与化合物EC2中化学键类型相同
下列反应中,属于取代反应的是()
①CH3CH=CH2+Br2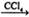 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH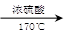 CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH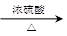 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3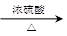 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电时的化学方程式为:2K2S2 +KI3=K2S4 +3KI。装置(Ⅱ)为电解含有0.5mol NaCl的溶液示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是
| A.K+从右到左通过离子交换膜 |
| B.电极A上发生的反应为:3I-﹣2e-=I3- |
| C.电极X上发生的反应为:2Cl-﹣2e-=Cl2↑ |
| D.当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L(标准状况)气体 |
下列离子方程式书写不正确的是()
| A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3+ + 7OH-=Al(OH)3↓+ AlO2- + 2H2O |
| B.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-=CuS↓+H2S↑ |
| C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2+ + 4Br- +3Cl2=2 Fe3+ + 2Br2 + 6Cl- |
| D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3 Fe +2NO3- +8H+=3Fe2+ +2NO↑+4H2O |
分子式为C5H12O,且分子结构中只含有2个甲基和1个羟基的有机物共有(不考虑立体异构)()
| A.3种 | B.4种 | C.5种 | D.6种 |