在1100 ℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) 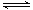 Fe(s)+CO2(g) ΔH=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g) ΔH=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是
| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L可将气体顺利排出 |
用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是( )
| A.醋酸的电离程度逐渐增大,溶液的PH值减小 | B.水的电离程度增大 |
| C.Kw逐渐减小 | D.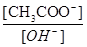 变大 变大 |
对水的电离平衡不产生影响的粒子是( )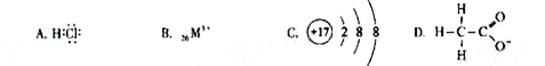
常温下,下列各组比值为1∶2的是()
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c (CH3COO-)之比 |
下图为两个原电池装置图,由此判断下列说法错误的是()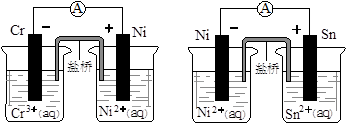
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
下列有关判断正确的是()
| A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+) |
B.能使紫色石蕊试液呈红色的溶液:Na+、NH 、I-、NO 、I-、NO 可以大量共存 可以大量共存 |
| C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O |