Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) ,△H=?,反应情况记录如下表:
pC(g) ,△H=?,反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= 。
(5) 判断第9 min时是否达平衡,说明理由 。
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为: 。
已知:格氏试剂是用卤代烃和镁在醚类溶剂中反应制得,它在有机合成上应用广泛。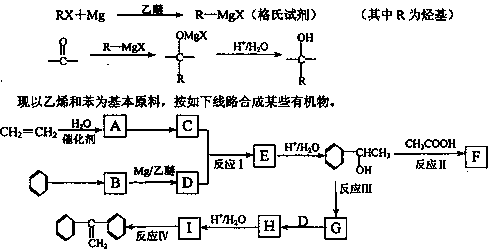
回答下列问题:
(1)C的结构简式__________。
(2)反应I的类型是__________。
(3)反应III的条件是__________。
(4)写出下列反应的化学方程式(要求注明反应条件)。
反应Ⅱ:______________________________;
反应Ⅳ:______________________________。
(5)G的同分异构体中,含有苯环且能发生银镜反应的有机物有_____种,请写出其中一种的结构简式为:_______________。
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,其中D为黄绿色。甲、乙、丙为常见的化合物。它们之间的转化关系如下图所示:
回答下列问题:
(1)化合物乙的名称__________。
(2)B与甲反应的化学方程式是____________________。
(3)由丙的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是__________;若要提纯该胶体,采用的操作方法叫_____。如果用该胶体做电泳实验,___极附近颜色加深。
(4)将A、B两种金属按一定的质量比组成混合物。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,混合物中B的物质的量为_____mol(用含字母的代数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积的标准状况下为mL,该反应中转移电子的物质的量为_____mol,原混合物中A的质量为__________g(用含字母的代数式表示)。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌后,过滤,沉淀经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中B的质量分数为_____。
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H22NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H22NH3,有关数据及平衡状态特点见下表。
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 |
D.形成1mol N N键的同时形成6molN—H键 |
(5)甲容器中氮气的转化率为_____。
(6)起始时,容器乙是容器甲压强的_____倍。
硫酸亚铁药片(外表包有一层特质的糖衣)是一种治疗铁性贫血的药剂。某化学课外活动小组为测定其中硫酸亚铁的含量,进行如下实验:
I.甲同学要测定其中铁元素含量,实验按以下步骤进行: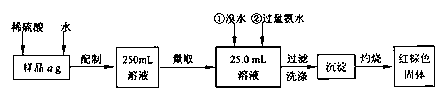
请根据上面流程,回答以下问题:
(1)刮除药片的糖衣,甲同学如下称得样品ag,则你认为a=_____。
(2)将其碾碎后迅速溶解,配制250mL溶液。配制溶液时除烧杯、玻璃棒、量筒、250mL容量瓶外,还必须有的玻璃仪器__________。
(3)洗涤沉淀的操作是_____________________________________________。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,据此结果,还应进行的操作是________________________________________。
根据测得的数据可计算出硫酸亚铁的含量。
II、乙同学根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,采用滴定的方法测定其中硫酸亚铁的质量分数。
(5)取上述甲同学所配置的待测液25.00mL置于锥形瓶中,并将0.02mol/L KMnO4的标准溶液装入_____(“酸式”或“碱式”)滴定管中,调节液面至“0”刻度。
(6)滴定操作时,眼睛注视_________________________。
(7)滴定待测液至终点,如此滴定三次,实验数据如下表所示:
(其中第一次滴定给点的数据如右图,请你你读得的数据填入表中)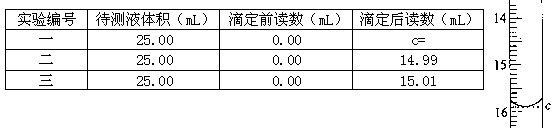
样品中硫酸亚铁的质量分数为_____。(保留3位有效数字)
【化学—选修5 有机化学基础】
洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如下图,请回答下列问题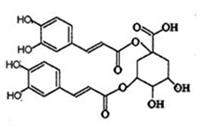
(1)洋蓟素分子中“苯环上的含氧官能团”的名称为;洋蓟素的水溶液显(填:中、酸、碱)性。
(2)有关洋蓟素说法错误的是
| A.是一种高分子化合物 |
| B.可以使酸性高锰酸钾和溴水褪色 |
| C.能与氯化铁发生显色反应 |
| D.1mol洋蓟素最多可与11molNaOH反应 |
E.不能与新制Cu(OH)2生成砖红色沉淀
(3)洋蓟素在酸性条件下水解,生成有机物M和R
①邻苯二酚与A物质发生加成反应可生成M,其化学方程式为: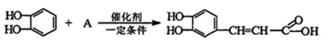
写出A的结构简式:;写出M的顺式结构简式:;
M与足量浓溴水发生化学反应的方程式为:
②将R与浓硫酸共热,写出其核磁共振氢谱中有六个吸收峰且峰面积相同的消去产物的结构简式: