农作物的种子经过发酵、蒸馏制得的乙醇被称为“绿色汽油”。乙醇的化学式为 现在用的汽油里面常常加入乙醇,被称为“乙醇汽油”,乙醇汽油属于 (混合物、纯净物),乙醇燃烧的化学方程式 。
铁是应用最广泛的金属。 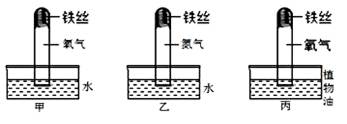
(1)为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。
一段时间后,甲中铁丝发生锈蚀且试管中液面上升,乙和丙中均无明显变化。由此得出铁丝锈蚀的过程,实际上是铁丝与、发生化学反应的过程;
(2)铁制品在下列情况:①潮湿空气中②部分浸入食盐水中③干燥的空气中,最易生锈的是(填序号,下同),不易生锈的是;
(3)在“南海一号”打捞出来的文物中,铁器锈迹斑斑,残存很少,请你列举出一种日常生活中常用的防止铁生锈的方法。
现有下列初中化学常用的制取气体部分装置。请完成以下各题: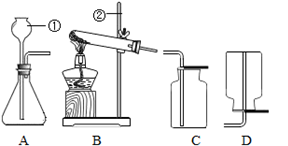
(1)写出上图①、②两种仪器的名称①__ __②__ __。
(2)以高锰酸钾为原料制取氧气,应选用_ ___和__ __装置(填字母)来制取并收集,反应的化学方程式是_ __;
A装置也可以作为制氧气的发生装置,反应的方程式是_ __,利用A装置还可以制;(填气体化学式)
(3)某老师带领学生进行上述实验时,发现“一同学不慎碰倒装满氧气的集气瓶,迅速扶起后,瓶中剩余的氧气仍能使带火星的木条复燃”;对此,小曹老师让该同学往集气瓶装入半瓶水,再用排水法收集1/2集气瓶的氧气,发现瓶中的氧气也能使带火星木条复燃。
①用下列方案收集“1/2集气瓶的氧气”,其中最合理的是(填字母);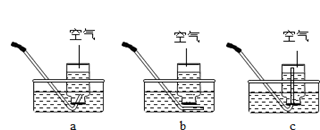
②用排水法收集气体时,如何判断集气瓶中气体已收集满?答:;
③空气中氧气的体积分数约为21%.本实验中,集气瓶内的氧气约占总体积的%,所以用“使带火星木条复燃”来检验集气瓶中充满氧气的方法不可靠。
矿物质水中元素及国标含量如下表所示,请回答下列问题.
| 矿物质水中主要成分(mg/1L) |
| 偏硅酸(H2SiO3)≥25硫酸根≥0.05 氯离子≤5Mu钙≥0.2 钠≥0.2钾≥0.2镁≥0.2 |
(1)矿物质水属于物(填“纯净”或“混合”);
(2)矿物质水中的元素能预防骨质疏松、佝偻病;(用化学符号表示,下同)
(3)久置的水中溶有一定量的氧气,请表示出2个氧分子;
(4)上表中的一种阴离子;
(5)硫酸钙中钙元素的化合价为+2价;
(6)产自溶洞的水中含有微量的二氧化碳,保持二氧化碳化学性质的最小粒子是;
(7)日常生活中常见的火灾可用水浇灭,下列关于火灾的说法正确的是。(选填序号)
A.家用电器着火,立刻用水浇灭
B.火灾中自救逃生时,用湿毛巾捂住口鼻
C.高层楼房失火时,立刻乘电梯离开
D.酒精泼洒在桌面上燃烧,立刻用湿抹布或沙土盖灭
(14分)人类的生产和生活都离不开金属。
Ⅰ.金属元素在自然界中分布很广,在地壳中主要以矿物形式存在。下列矿石的主要成分不属于氧化物的是(填序号),孔雀石中铜元素的化合价;如将一定量的铁加入到硫酸铜和硫酸锌的混合溶液中,充分反应后,滤液中一定含有的溶质是,滤渣中一定含有。
Ⅱ.铁是应用最广泛的金属。
(1)下图是工业炼铁示意图。其中,焦炭的作用是燃烧提供能量和;写出有铁生成的化学方程式为。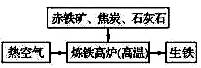
(2)某兴趣小组在实验室中模拟炼铁的化学原理,用一氧化碳还原纯净的氧化铁粉末,实验装置如图。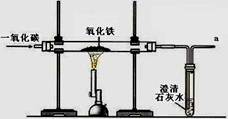
①实验中玻璃管里固体粉末的颜色变化是,澄清的石灰水中发生反应的化学方程式是。
②该装置有何不妥?。
(3)该化学兴趣小组的同学利用改正后的装置对一份由铁粉和氧化铁组成的混合物进行探究。他们取了7.2g固体样品放入硬质玻璃管通入足量的CO进行实验,高温灼烧至质量不再变化,称得玻璃管中固体质量为6g,请计算:
①该混合物中铁元素与氧元素的质量比。
②该混合物中铁粉的质量分数。(结果保留一位小数)
某化学兴趣小组的同学利用下图装置进行实验室制取气体的探究。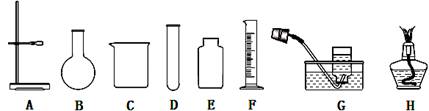
(1)写出下列仪器的名称:C;F。
(2)小明同学用图中的A、D、G、H仪器组装成氧气发生装置,请你推测该同学选用的化学药品是;用这套装置制取氧气的主要操作有:①装药品 ②检查装置的气密性 ③固定装置 ④加热 ⑤收集气体 ⑥撤酒精灯 ⑦从水槽撤出导气管。正确的操作顺序是(填序号)。
(3)小亮同学想用下图装置制取二氧化碳,写出该反应 的化学方程式。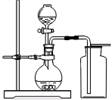
该装置还可以用于制取并收集的气体有。
(4)带火星的木条在盛过氧化氢的试管中不能复燃,而在加热或加入二氧化锰后能复燃。请你归纳影响过氧化氢分解速率的因素有等。