分析下列反应在任何温度下均能自发进行的是
| A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1 |
B.Ag(s)+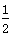 Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1 Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1 |
C.HgO(s)===Hg(l)+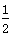 O2(g) ΔH=+91 kJ·mol-1 O2(g) ΔH=+91 kJ·mol-1 |
D.H2O2(l)=== 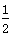 O2(g)+H2O(l) ΔH=-98 kJ·mol-1 O2(g)+H2O(l) ΔH=-98 kJ·mol-1 |
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |
一定条件下反应N2(g)+3H2(g)  2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
| A.1.2mol/(L·min) | B.6mol/(L·min) |
| C.0.6mol/(L·min) | D.0.4mol/(L·min) |
下列三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2NaCN+HF=HCN+NaFNaNO2+HF=HNO2+NaF
由此可判断下列叙述中正确的是
| A.HF的电离平衡常数是① | B.HNO2的电离平衡常数是① |
| C.HCN的电离平衡常数是② | D.HNO2的电离平衡常数是③ |
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
| A.①③⑤⑦⑧ | B.②④⑦ | C.①⑥ | D.②④⑥⑧ |
下列说法正确的是
| A.强电解质一定是离子化合物 | B.强电解质、弱电解质的电离都是吸热过程 |
| C.强电解质的饱和溶液一定是浓溶液 | D.强电解质在水中一定能全部溶解 |