温度一定时, 于密闭容器中发生可逆反应: mA(气) + nB(气)  pC(气), 达到平衡后,若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍,则下列叙述中正确的是
pC(气), 达到平衡后,若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍,则下列叙述中正确的是
| A.平衡向逆反应方向移动 |
| B.C气体的体积分数增大 |
| C.气体A的转化率升高 |
| D.m + n > p |
根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
H2SO3+I2+H2O 2HI+H2SO4
2HI+H2SO4
2FeCl3+2HI 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
3FeCl2+4HNO3 2FeCl3+NO↑+2H2O+Fe(NO3)3
2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
实验表明:将氯水滴加到一片蓝色石蕊试纸上,会出现如右图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是( )
| A.此实验表明氯水有酸性、漂白性 |
| B.内环呈白色,外环呈红色或浅红色 |
| C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 |
| D.氯水中形成次氯酸的反应中还原产物是HClO |
对氯水处理或氯水与下列物质反应过程中不会产生气体的是( )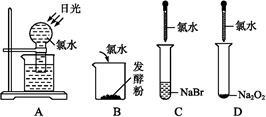
下列同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是( )
| A.Na2CO3+HNO3与NaHCO3+HNO3 |
| B.CaCl2+Na2CO3与Ca(NO3)2+K2CO3 |
| C.Ba(OH)2+NaHSO4与BaCl2+NaHSO4 |
| D.NaOH+H2SO4与Fe(OH)3+H2SO4 |
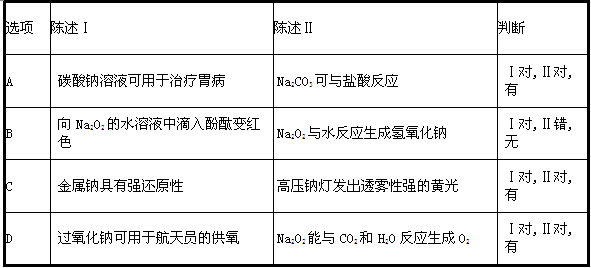
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )