下列实验中,反应速率加快是由催化剂引起的是
| A.在炭粉中加入KClO3 ,点燃时燃烧更为剧烈 |
| B.H2O2中加入少量FeCl3,即可迅速放出气体 |
| C.将炭块粉碎成粉末状,可使燃烧更加充分 |
| D.锌与稀硫酸反应中加入少量硫酸铜,产生氢气速率加快 |
某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )。
| A.用铜片、铅笔芯作电极插入稀硫酸中 |
| B.用两个铜片作电极插入硝酸银溶液中 |
| C.用锌片、铜片作电极插入番茄中 |
| D.用铜片、铁片作电极插入酒精中 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )。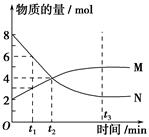
A.化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
一定条件下,可逆反应2A B+3C,在下列四种状态中,处于平衡状态的是( )。
B+3C,在下列四种状态中,处于平衡状态的是( )。
| 正反应速率 |
逆反应速率 |
|
| A |
vA=2 mol·L-1·min-1 |
vB=2 mol·L-1·min-1 |
| B |
vA=2 mol·L-1·min-1 |
vC=2 mol·L-1·min-1 |
| C |
vA=1 mol·L-1·min-1 |
vB=2 mol·L-1·min-1 |
| D |
vA=1 mol·L-1·min-1 |
vC=1.5 mol·L-1·min-1 |
在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)  CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )。
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )。
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n mol CO的同时生成n mol H2 |
| D.1 mol H—H键断裂的同时断裂2 mol H—O键 |
一定条件下,对于反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零)。达平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )。
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零)。达平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )。
①c1∶c2=1∶3 ②平衡时,Y和Z的生成速率之比2∶3
③X和Y的转化率不相等 ④c1的取值范围为0<c1<0.14 mol·L-1
| A.①② | B.③④ | C.①④ | D.②③ |