在101 kPa和25℃时,有关反应的热化学方程式如下:
下列说法正确的是
| A.C(s)+H2O(g)===CO(g)+H2(g) ΔH=-131.2 kJ·mol-1 |
| B.表示H2燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
| C.2H2O(g)===2H2(g)+O2(g) ΔH=-483.4 kJ·mol-1 |
| D.H2O(g)===H2O(l)ΔH=-44.1 kJ·mol-1 |
用NA代表阿伏加德罗常数。下列说法正确的是( )
| A.1molNH3中含有3NA对电子对 |
| B.工业用电解法进行粗铜精炼时,每转移lmol电子,阳极上溶解的铜原子数必为0.5NA |
| C.将2molSO2和lmolO2混合在V2O5存在条件下的密闭容器中,充分反应分子总数等于2NA |
| D.VLamol·L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
下列正确的叙述有( )
① CO2、NO2、P2O5均为酸性氧化物
② Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③ 碘晶体分散到酒精中、氯化钠晶体分散到酒精中所形成的分散系分别为:溶液、胶体
④ 灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤ 需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑥ 氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成⑦ 按照纯净物、混合物、强弱电解质和非电解质顺序排列的是单甘油酯、混甘油酯、苛性钾、次氯酸、氯气
⑧ 金属元素和非金属元素形成的化合物一定是离子化合物
| A.3个 | B.4个 | C.5个 | D.6个 |
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池反应通常表示为
LaNi5H6+6NiO(OH)==LaNi5+6Ni(OH)2。下列说法正确的是
| A.放电时储氢合金作正极 |
| B.放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+ |
| C.充电时阳极周围c (OH-)减小 |
| D.充电时储氢合金作负极 |
有研究发现,奥司他韦可以有效治疗H1N1流感,奥司他韦分子式为C16H28N2O4·H3PO4,分子结构如图,是一种纳米级药物,下列有关奥司他韦的说法中正确的是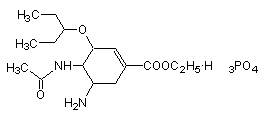
| A.只含极性键,易溶于水,其水溶液有丁达尔效应 |
| B.分子中只含有酯基、氨基、肽键三种官能团 |
| C.1mol 该物质最多能与4molNaOH反应 |
| D.可以发生加成、取代、氧化反应 |
下列溶液中微粒的物质的量关系正确的是
| A.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4) |
| B.①0.2mol/LNH4Cl溶液、②0.1mol/L (NH4)2 Fe(SO4)2溶液、③0.2mol/LNH4HSO4溶液 ④0.1mol/L(NH4)2 CO3溶液中,c(NH4+)大小:③>②>①>④ |
| C.0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合: c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
| D.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-) |