短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一。
| X |
|
|
|
| Z |
|
W |
Y |
(1)写出W的原子结构示意图: 。
(2)已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(3)ZO是由单质X和ZO2反应制取单质Z的中间产物(空气中极不稳定)。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为__________________________。
(4)元素Y的Ca盐和H2为原料,反应产物只有甲和乙两种且均为化合物。研究发现:化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。则乙的化学式为 ;甲与水反应可得H2,其化学方程式是: 。
(5)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。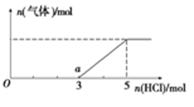
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+):c(Cl-)= _______________。
(1) 49gH2SO4分子_________mol,含有O原子___________个。完全溶于水,配成2 L溶液,则所得溶液的物质的量浓度为_____________________。
(2)同温同压下,质量相同的五种气体: ① CO2 ② H2 ③ O2 ④ CH4 ⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________; 所含原子数由多到少的顺序是__________________________; 密度由大到小的顺序是_________________________________。
(6分)在火箭推进器中装有还原剂肼(N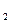 H
H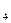 )和强氧化剂H
)和强氧化剂H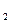 O
O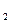 ,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H
,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H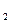 O
O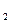 反应生成氮气和水蒸气时放出256.64 kJ的热量。
反应生成氮气和水蒸气时放出256.64 kJ的热量。
(1)写出液态肼和液态H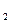 O
O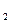 反应的热化学方程式。
反应的热化学方程式。
(2)已知H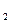 O(l)="===" H
O(l)="===" H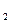 O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H
O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H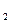 O
O 反应生成氮气和液态水时,放出的热量是_____________________。
反应生成氮气和液态水时,放出的热量是_____________________。
(3)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是_______________________________________________________________。
已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率___________(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡___________。
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达 到平衡时,C的体积分数为_____________,容器的容积为_____________。
到平衡时,C的体积分数为_____________,容器的容积为_____________。
(8分)(1)对于下列反应:2SO2(g) + O2(g) 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
(2)下图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压 强时的反应速率变化情况画在c~d处:
强时的反应速率变化情况画在c~d处:
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内混合气体的平均相对分子质量比原平衡时___________(填“增大”、“减小”或“相等”)。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。