能正确表示下列反应的离子方程式是
| A.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+ 6H+=2Mn2+ + 5NO3-+ 3H2O |
| B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-=CO32-+ NH3•H2O +H2O |
C.用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO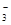 +5I-+6H+=I2+3H2O +5I-+6H+=I2+3H2O |
| D.用惰性电极电解熔融氯化钠: 2Cl—+2H2O=Cl2↑+H2↑+2OH- |
在一定条件下,下列有机物都能发生加成反应、取代反应、水解反应和中和反应共四种反应的是
A.一滴香: |
B.芬必得: |
C.维生素B5: |
D.扑热息痛: |
下列物质性质的比较,正确的是
| A.热稳定性:Na2CO3>NaHCO3>H2CO3 |
| B.熔点:熔点:K>Na>Li |
| C.同条件下,同浓度溶液的pH值:NaHCO3>Na2CO3 |
| D.还原性:S2->Br->I- |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是 ( )
| A.两种气体的压强相等 | B.O2比O3质量小 |
| C.两种气体的分子数目相等 | D.两种气体的氧原子数目相等 |
类比归纳是学习化学的重要方法,下列类比的说法正确的是 ( )
| A.CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 |
| B.MgO、Al2O3都是高熔点离子化合物,熔化时都能导电 |
| C.CO2与SiO2都是第IV A族的最高氧化物,则它们的物理性质也相似 |
| D.Al2O3与Fe2O3化学式相似,都是不溶于水的碱性氧化物 |
下列说法正确的是 ( )
| A.离子化合物中一定含有金属元素 | B.构成分子晶体的微粒中一定含有共价键 |
| C.原子晶体熔化要破坏共价键 | D.只有离子化合物中才存在离子 |