已知:还原性 >I-,氧化性
>I-,氧化性 ,在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是
,在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是
A.0~b间的反应可用如下离子方程式表示: |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中的I-为0.4 mol时,加入的KIO3只能是0.4mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
下列关于物质性质变化的比较,正确的是
| A.非金属性强弱: I>Br>Cl | B.原子半径大小:Na>P> S |
| C.碱性强弱:KOH>NaOH>LiOH | D.金属性强弱: Na>Mg>Al |
下列物质中,含有共价键的是
| A.NaOH | B.H2 | C.NaCl | D.H2S |
根据元素周期表和元素周期律分析下面的推断,其中正确的是
| A.锂、钠、钾的原子失电子能力逐渐增强 | B.钠比镁活泼 |
| C.溴单质的氧化性比氯气强 | D.氢氧化钠比氢氧化钾的碱性强 |
下列关于F、Cl、Br、I性质的比较,正确的是
| A.它们的原子核外电子层数随核电荷数的增加而增多 |
| B.单质的颜色随核电荷数的增加而加深 |
| C.它们的氢化物的稳定性随核电荷数的增加而增强 |
| D.被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 |
短周期中三元素a、b、c在周期表中的位置如图,下列叙述正确的是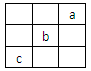
| A.a是一种活泼的非金属元素 | B.b的氢化物很稳定 |
| C.c的最高价氧化物的水化物是一种强酸 | D.b的最高化合价为+7 |