实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,Fe3+在pH=5时已完全沉淀,其中分析不正确的是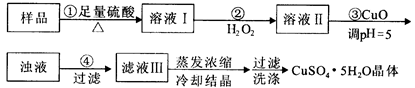
| A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果 |
| B.步骤②中加入H2O2的目的是将Fe2+氧化成Fe3+ |
| C.上述冷却结晶若改用蒸发结晶也能得到上述产物 |
| D.配制240 mL 1mol·L-1的CuSO4溶液,需称量CuSO4•5H2O的质量为62.5g |
下列离子能大量共存的是
| A.无色酚酞试液呈红色的溶液中:Na+ 、K+、SO42-、CO32 |
| B.无色透明的溶液中:Cu2+、K+、SO42-、NO3- |
| C.含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- |
| D.紫色石蕊试液呈红色的溶液中:Ca2+、K+、CO32-、NO3- |
下列反应中,电子转移方向和数目正确的是()
下列离子方程式正确的是
| A.硝酸银溶液与铜:Cu+Ag+="Cu2++Ag" |
| B.氧化铜与盐酸反应:O2-+2H+=H2O |
| C.碳酸钡与盐酸:CO32-+2H+=H2O+CO2↑ |
| D.Cu(OH)2加入H2SO4:2H++Cu(OH)2 =" Cu2+" +2H2O |
若以w1和w2分别表示物质的量是浓度为c1 mol·L-1和c2 mol·L-1硫酸溶液的质量分数,已知2 w1=w2,则下列推断正确的(硫酸的密度比纯水的大)
| A.2c1=c2 | B.2c2=c1 | C.c2>2c1 | D.c1<c2<2c1 |
以NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.在H2O2 + Cl2 ="2HCl" + O2反应中,每生成32g氧气,则转移4NA个电子 |
| B.100mL 0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
| C.常温常压下,6gO2和26gO3混合气体中的原子总数为2NA |
| D.标准状况下,2.24L CCl4所含的原子数为0.5NA |