下列各化学反应的离子方程式中,有错误的是
| A.铝与氢氧化钠反应:2Al+2OH-+2H2O=2AlO2-+3 H2↑ |
| B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
| C.碘化亚铁溶液中滴入足量溴水:2Fe2++2I-+2Br2=I2+2Fe3++4Br- |
| D.碳酸氢镁溶液中加过量澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓ |
下列与有机物的结构、性质有关的叙述不正确的是()
| A.甲烷和乙烯都可以与氯气反应,反应类型不同 |
| B.蔗糖、油脂、蛋白质都可以水解 |
| C.乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
| D.乙醇和乙酸都存在碳氧双键,二者可以发生酯化反应 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为()
| A.0.24 mol | B.0.16 mol | C.0.21 mol | D.0.14 mol |
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是()
| A.X一定只由CO组成 |
| B.X一定只由H2和CO2组成 |
| C.X可能由0.1 g H2和4.4 g CO2组成 |
| D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是()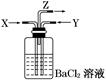
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是亚硫酸钡和碳酸钡 |
| D.在Z导管的出口处会有红棕色气体出现 |
下列叙述正确的是()
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.某无色溶液中通入Cl2,溶液变为淡黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I-
C.CO2、NO2、SO2都能与H2O反应,其反应原理相同
D.C、N、S三种单质直接与O2反应都能生成两种氧化物