下列有关实验操作、现象和解释或结论都正确的
| 选项 |
实验操作 |
现象 |
解释或结论 |
| ① |
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
| ② |
AgI沉淀中滴入稀KCl溶液 |
有白色沉淀出现 |
AgCl比AgI更难溶 |
| ③ |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被HNO3氧化,形成致密的氧化膜 |
| ④ |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
| ⑤ |
将浓硫酸滴到蔗糖表面 |
固体变黑膨胀 |
浓硫酸有脱水性和强氧化性 |
| ⑥ |
将足量的H2O2溶液滴入KMnO4溶液中 |
KMnO4溶液褪色 |
2MnO4-+7H2O2+6H+=2Mn2++6O2↑+10H2O |
| ⑦ |
将一小块Na放入无水乙醇中 |
产生气泡 |
Na能置换出醇羟基中的氢 |
| ⑧ |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下反应 |
A.①④⑤⑥⑦ B.④⑤ C.④⑤⑦ D.①⑤
35Cl和37Cl是氯元素的两种核素,下列说法正确的是
| A. 35Cl2与37Cl2互为同位素 |
| B.35Cl与37Cl的原子结构示意图不同 |
| C.通过化学变化可以实现35Cl与37Cl间的相互转化 |
| D.常温常压下,1.12LH35Cl与1.12LH37Cl所含原子总数相等 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。下列说法正确的是()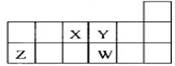
| A.元素Z位于元素周期表中第3周期第ⅠA族 |
| B.原子半径的大小顺序为:rW> rZ >rY> rX |
| C.Y、W元素的氢化物,其化学式都为H2R |
| D.离子Y2-和Z 3+的核外电子数和电子层数都相同 |
下列叙述正确的是()
| A.某元素由化合态变成游离态,该元素一定被氧化 |
| B.卤素离子(X-)只有还原性而无氧化性 |
| C.失电子难的原子获得电子的能力一定强 |
| D.负一价卤素离子的还原性在同一族中从上至下逐渐增强 |
下列叙述中,不正确的是()
| A.工业上HCl由H2和Cl2在点燃的条件下制得 |
| B.氢氟酸比盐酸的酸性强 |
| C.碘难溶于水,易溶于有机溶剂 |
| D.碘单质能使湿润的碘化钾淀粉试纸变蓝 |
某元素原子最外层电子层上只有一个电子,该元素()
| A.一定是金属元素 | B.可能是金属元素,也可能不是金属元素 |
| C.一定是ⅠA族元素 | D.一定是非主族元素 |