某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是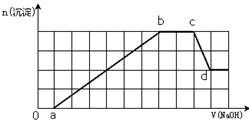
| A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B.ab段发生的离子反应为:Al3++3OH—= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ |
| C.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| D.d点溶液中含有的溶质只有Na2SO4 |
下列反应中HNO3既表现出酸性又表现出强氧化性的是()
| A.稀硝酸与CuO反应 | B.稀硝酸与NaOH 溶液反应 |
| C.浓硝酸与灼热的碳反应 | D.浓硝酸与铜反应 |
氨氧化制硝酸的反应如下(未配平):①NH3 + O2 →NO + H2O②NO + O2 → NO2
③NO2+H2O→HNO3+NO,如将氨全部氧化得2mol硝酸,理论上需氧气的物质的量是( )
| A.2mol | B.3 mol | C.4 mol | D.5 mol |
下列说法正确的是()
| A.硫粉在过量的氧气中燃烧可以生成SO3 |
| B.可以用澄清石灰水鉴别CO2和SO2 |
| C.将少量CO2通入BaCl2溶液能生成白色沉淀 |
| D.不能用排水法收集SO2、NO2气体 |
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。现有三种制取硝酸铜的实验方案可供选用:①铜与稀硝酸反应制取:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O
②铜与浓硝酸反应制取:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:2Cu + O2  2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O下列有关说法正确的是()
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O下列有关说法正确的是()
| A.制取等量的硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )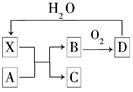
| A.X使蔗糖变黑的现象主要体现了X的强氧化性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可看到白色沉淀 |
| D.工业上,B转化为D的反应条件为高温、常压、使用催化剂 |