Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2):n(NO)=1:1时,下列说法正确的是
| A.1 mol Cu2S参加反应时有8 mol电子转移 |
| B.参加反应的n(Cu2S):n(HNO3)=1:5 |
| C.反应中Cu2S既作氧化剂,又作还原剂 |
| D.产物n[Cu(NO3)2] : n[CuSO4 ]=l:1 |
下列说法不正确的是
| A.化石燃料燃烧产生大量CO2,会导致温室效应 |
| B.血液透析利用了胶体的性质 |
| C.自来水可用氯气来杀菌消毒,说明氯气无毒 |
| D.采用原煤脱硫技术,可减少燃煤燃时产生的SO2 |
往含KI和KCl的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则下列说法正确的是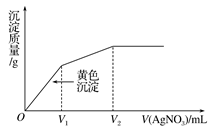
A.原溶液中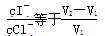 |
B.原溶液中 |
| C.V2时取上层清液做焰色反应火焰呈黄色 |
| D.V2时生成沉淀的总物质的量与加入AgNO3的总物质的量相等 |
对于某些离子和物质的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,说明一定有CO32— |
| B.用洁净的铂丝蘸取某溶液放在无色火焰上灼烧,若火焰呈黄色,说明溶液中含有Na+ |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,一定有SO42— |
若NA表示阿佛加德罗常数,下列说法正确的是
| A.1 mol Cl2作为氧化剂得到的电子数为NA |
| B.在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 |
| C.14 g氮气中含有7NA个电子 |
| D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶2 |
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
| A.1∶2∶3 | B.3∶2∶2 | C.3∶1∶1 | D.1∶3∶3 |