下列实验操作或结论正确的是
| A.配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 |
| B.实验室里需要480 mL 2.0 moI·L-1氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作 |
| C.25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变 |
| D.K2CO3在酒精灯上灼烧时能直接观察到紫色火焰 |
10mL某气态烃在80mL 中充分燃烧,得到液态水和体积为65mL的混合气体(气体体积均在相同条件下测定),该气态烃不可能是
中充分燃烧,得到液态水和体积为65mL的混合气体(气体体积均在相同条件下测定),该气态烃不可能是
| A.丙烷 | B.乙烷 | C.丙烯 | D.甲烷 |
下列不属于取代反应的是
| A.CH4+Cl2光照,CH3Cl+HCl |
| B.CH3Cl+Cl2光照,CH2Cl2+HCl |
| C.CH4+2O2―→CO2+2H2O |
D.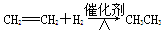 |
下列说法中,正确的是
| A.芳香烃的分子通式是CnH2n-6(n≥6) |
| B.苯的同系物是分子中仅含有一个苯环的所有烃类物质 |
| C.苯和己烷都不能使KMnO4酸性溶液褪色 |
| D.苯和甲苯都能与卤素单质、硝酸等发生取代反应 |
下列物质能用于萃取溴水中的溴的是
| A.直馏汽油 | B.裂化汽油 | C.酒精 | D.己烷 |
某有机化合物的结构简式如图所示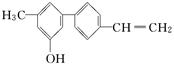
下列关于该化合物的说法正确的是
| A.由于含有氧元素不是有机物 |
| B.完全燃烧时只有二氧化碳和水两种产物 |
| C.分子中苯环上连有羟基属于酚 |
| D.不能使溴水褪色 |