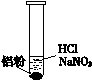
(10分)一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
| 装 置 |
现 象 |
 |
ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
| 实验 |
内容 |
现象 |
| 实验1 |
将湿润KI—淀粉试纸置于空气中 |
未变蓝 |
| 实验2 |
用湿润KI—淀粉试纸检验浅棕色气体 |
试纸变蓝 |
①盐酸溶解Al2O3薄膜的离子方程式是____ __。
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是______。
b.实验1的目的是_ 。
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整: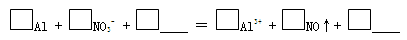
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。
重新设计实验证实如下:
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
① 刺激性气味的气体是________________。 ② 产生该气体的离子方程式是__ 。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是__ ____。
(5)实验结果证实:NO3‑在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。习题中的无色溶液一定能大量存在的是Na+和OH-。
实验室需用CuSO4·5H2O体配制480mL0.1mol/L的CuSO4溶液,请回答下列问题:
(1)应用托盘天平称取CuSO4·5H2O晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的CuSO4·5H2O晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)配制过程中有几个关键的步骤和操作如下图所示:将这些实验步骤A—F按实验过程先后次序排
列。
其中定容的具体操作是。
(5)以下情况会使所配溶液的浓度产生何种影响(A.偏高 B.偏低 C.不变,填序号。):
①溶解晶体用的烧杯和玻璃棒未洗涤:____________;
②定容时俯视刻度线:____________;
③所用CuSO4·5H2O晶体已失去部分结晶水:____________。
某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母)。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示:
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol)。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
| 温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/ml,中和后生成溶液的比热容
C=4.18J/(g.℃)。则中和热△H=(取小数点后一位)。
③上述实验结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
下面是几种实验中常用的仪器:
A. B.
B. C.
C. D.
D.
(1)写出序号所代表的仪器的名称:B___________;C___________;D___________
实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)下列主要操作步骤的正确顺序是_______________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②“定容”
③待冷却至室温后,将溶液转移到500 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2—3次,洗涤液转移到容量瓶中。
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
(5)写出步骤②“定容”的具体操作:
(6)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。某学生课
外活动小组欲从海藻中提取碘,设计如下的流程:
(已知过程②中反应的离子方程式为:2I- + Cl2 = 2Cl- + I2)
Ⅰ.指出提取碘的过程中有关的实验操作的名称:①, ③。
Ⅱ.提取碘的过程中,可选择的有机溶剂是(填序号) 。
A、酒精 B、醋酸 C 、四氯化碳
某校课外活动小组为探究铜与稀硝酸反应产生的气体主要是NO,设计了下列实验。图中K为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去。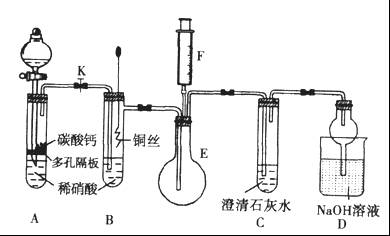
请回答有关问题:
(1)设计装置A的目的是_______________________。
(2)当完成装置A的实验目的后,关闭K,再将装置B中的铜丝插入稀硝酸。B中反应的离子方程式是____________________________。
(3)将F中的空气推入E中,证明NO存在的实验现象是_______________,此过程发生反应的化学方程式是____________________。
(4)装置D中 溶液的作用是________________。
溶液的作用是________________。
以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
请回答下列问题:
(1)流程图中操作①、②、③分别指的是①_________、②__________、③________。
操作④、⑤用到的主要仪器是:④__________、⑤__________(每空填1-2个仪器)。
(2)判断溶液中SO42-离子已沉淀完全的方法是_________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,
| A.用带有刻度的烧杯配制成100 mL试样溶液。 | B.用量筒量取25.00 mL待测溶液, | C.并置于锥形瓶中。 | D.用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,(E)当溶液变成淡紫红色时,停止滴定,如30秒内不褪色,(F)读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量。请指出该实验过程中错误操作步骤的编号________________________。 |
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是_____________________________________________。
(5)称取矿石试样1.60 g, 按方法Ⅰ分析,称得BaSO4的质量为4.66 g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是___________。