已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为: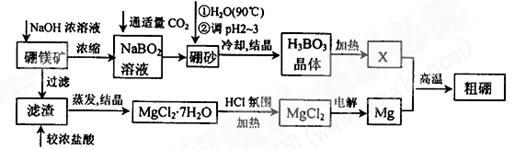
回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则当溶液pH=6时, (填“有”或“没有”)Mg(OH) 2沉淀析出。(已知Ksp[Mg(OH) 2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为__ __(提示:I2+2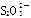 ===2I-+
===2I-+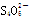 )(结果保留一位小数)。
)(结果保留一位小数)。
按要求填空
(1)对下列物质进行命名 :________________________;
:________________________; :______________________;
:______________________; :__________________;
:__________________; :_____________________;
:_____________________;
(2)写出下列物质的结构简式
2,4,6三甲基辛烷:_______; 1,3丁二烯:________
完成下列反应式,并说明反应类型。
(1)丙烯通入溴水中
(2)2—丁烯在催化剂作用下生成聚2—丁烯
(3)由苯制硝基苯.
将稀硝酸逐滴加入盛有铝铁合金的容器中,当固体恰好完全溶解时,产生标准状况下NO 40.32L,将反应后的溶液平均分成三等份,分别进行如下实验:
(1)第一份溶液中逐滴加入2 mol·L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,则需加入NaOH溶液的体积为________________。
(2)第二份溶液中边加入NaOH溶液,边在空气中充分搅拌,至恰好达到最大沉淀量,将产生的沉淀过滤、洗涤、干燥、称量比第一份重5.1g,则该过程中消耗O2的物质的量为_______________。
(3)第三份溶液中逐滴加入4 mol·L-1NaOH溶液,至Al(OH)3沉淀恰好溶解,消耗NaOH溶液500mL,计算原合金中铝的质量。(写出解题过程)(4分)
(14分)X、Y、Z、D、E、W是原子序数依次递增的短周期主族元素。
(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化学方程式为________________________________;Y与氢原子按个数比1:2形成的含18个电子的化合物的电子式为________________。
(2)X、E同主族,纯净的单质E可用于制太阳能电池,则X在周期表中的位置是________________;X与E作电极,同NaOH溶液可构成原电池,则该电池负极的电极反应式为:______________。
(3)常温常压下,W的单质为气体,且常用于自来水的消毒,W的一种氧化物W2O是酸性氧化物,W2O与水反应的方程式为________________________________,W2O的结构式为_____________。
(4)Z、D、E、W同周期,D的简单离子半径是同周期简单离子中半径最小的, D的单质与Z的最高价氧化物对应水化物反应的离子方程式为________________________________。
(5)(XY)2与W2性质相似,则(XY)2分子中含有的化学键有_____________________(填“离子键”、“极性键”或“非极性键”);(XY)2的制备原理同实验室制取W2类似,在酸性条件下用MnO2氧化对应的阴离子得到。写出制取(XY)2的离子方程式________________________________。
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
450 |
|
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 元素主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请总结表中知识规律,并依据元素周期律回答下列问题:
(1)单质硒的熔点范围可能是________________。
(2)元素碲的主要化合价可能有________________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________(用化学式表示)。
(4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表________________, d代表(均写单质名称)。