已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若在常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8 mL 0.01 mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
| A.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
运用相关化学知识进行判断,下列结论正确的是
| A.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.过氧化钠是强氧化剂,能氧化二氧化碳,因此过氧化钠可作呼吸面具中的供氧剂 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
在下列变化过程中,被破坏的微粒间作用力正确的是
| A.冰融化一一共价键 |
| B.二氧化硅熔融——范德华力 |
| C.氢氧化钠溶于水——离子键、共价键 |
| D.硫酸氢钠溶于水——离子键、共价键 |
下列有关化学用语表示正确的是
| A.质子数为53、中子数为78的碘原子:13153I |
B.硫离子的结构示意图: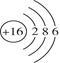 |
| C.H2O2的结构式:H—O—H—O |
D.NH4I的电子式: |
化学与日常生活密切相关,下列说法错误的是
| A.Si可用于制造半导体材料 |
| B.二氧化硫可广泛用于食品的增白 |
| C.大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| D.84消毒液的有效成分是NaClO,可用于环境的消毒杀菌 |
利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
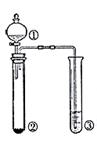 |
| A |
浓盐酸 |
Na2CO3 |
Na2SiO3溶液 |
非金属性:Cl > C > Si |
|
| B |
稀硫酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
|
| C |
浓氨水 |
碱石灰 |
AlCl3溶液 |
Al(OH)3是两性氢氧化物 |
|
| D |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |