(10分)在80℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为________。
(2)计算在80℃时该反应的平衡常数K=________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)下图是80℃时容器中N2O4物质的量的变化曲线,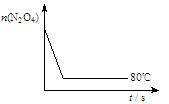
请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
如下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体, 1 mol X分解得到A、B、C各1 mol。
试回答下列各题:
(1)写出下列物质的化学式:X________,B________。
(2)写出下列反应的化学方程式:
①H+G―→A+F:__________________________________________________________。
②C+D―→E:__________________________________________________________。
(3)写出下列反应的离子方程式:
G+Cu―→E:___________________________________________________________。
电子仪表部件常用的一种高分子材料DAP的结简式为: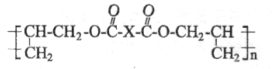 X为未知部分的结构,各物质间有如下转化:
X为未知部分的结构,各物质间有如下转化:
试根据下列信息回答相关问题:
已知:
(1)A是一种脂肪烃,B的官能团的名称是___________,B生成C的化学反应方程式是_____________。
(2)D的分子式是 ,分子内所有碳原子共平面,D在一定条件下可以生成五元环酯,其结构简式是______________。
,分子内所有碳原子共平面,D在一定条件下可以生成五元环酯,其结构简式是______________。
(3)F发生银镜反应的化学方程式是_____________________。
(4)F有多种同分异构体。符合下列要求的同分异构体共有__________种。
①属于芳香族化合物②能发生银镜反应③核磁共振氢谱显示苯环上只有一种氢
(5)G在一定条件下合成高分子化合物N的化学方程式是________________。
随着科学的发展,科学家们合成了一些氙的化合物。请回答下列问题。
(1)Xe原子的价电子排布式为_________。稀有气体中只有密度较大的氙能合成出多种化合物,其原因是____________。
A.氙含量比较丰富B.氙原子半径大,电离能小C.氙原子半径小,电离能大
(2)研究报告指出:“关于XePtF6”的化合价有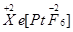 、
、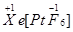 两种可能,经证实
两种可能,经证实 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定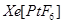 中化学键类型为________。
中化学键类型为________。
(3)金属 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
已知金属Pt的密度为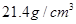 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
(4)氙的含氧化合物主要有 和
和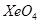 ,它们都有很强的氧化性,
,它们都有很强的氧化性, 的分子构型是__________,
的分子构型是__________,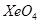 中Xe原子的杂化类型是_______,与
中Xe原子的杂化类型是_______,与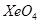 分子互为等电子体的离子有___________(填一种)。
分子互为等电子体的离子有___________(填一种)。
焦亚硫酸钠(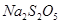 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下: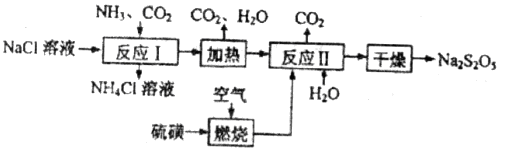
已知:反应Ⅱ包含 等多步反应。
等多步反应。
(1)反应Ⅰ的化学方程式为____________,反应Ⅰ进行时应先通入__________气体。
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是__________。在上述工艺流程中可循环使用的物质是_____________。
(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近____________,若气体量不足,则会导致_______________。
(4)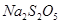 与稀硫酸反应放出
与稀硫酸反应放出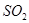 ,其离子方程式为___________。
,其离子方程式为___________。
“节能减排”,减少全球温室气体排放,意义十分重大。二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的 。
。
(1)使用过量 溶液吸收
溶液吸收 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
(2)①以 和
和 为原料可合成化肥尿素[
为原料可合成化肥尿素[ ]。已知:
]。已知:
 ①
①
 ②
②
 ③
③
试写出 和
和 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。
② 通过反应可转化为
通过反应可转化为 ,在催化剂作用下CO和
,在催化剂作用下CO和 反应生成甲醇:
反应生成甲醇: 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。
A.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=__________;平衡状态B点时容器的容积 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间 _______
_______ (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
C.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是________(写出一种即可)。