下列各种应用中,利用了硅元素的还原性的是
| A.用硅制造集成电路、晶体管等半导体器件 |
| B.在野外,用硅、石灰、烧碱的混合物制取氢气:Si + Ca (OH)2 + 2NaOH = Na2SiO3 + CaO +2H2↑ |
| C.用HF酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O |
D.单质硅的制备: SiO2 + 2C Si + 2CO↑ Si + 2CO↑ |
下列各组物质混合后,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液②过量NaOH溶液和明矾溶液
③过量生石灰投入到少量饱和NH4HCO3溶液④NaHCO3投入AlCl3溶液
| A.只有① | B.只有③ | C.只有②③ | D.只有①③④ |
判断下列有关化学基本概念的依据正确的是
| A.单质:是否只含一种原子 | B.氧化还原反应:元素化合价是否变化 |
| C.共价化合物:是否含有共价键 | D.强电解质:熔融状态下是否完全电离 |
下列离子方程式中正确的是
| A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH-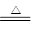 NH3↑+ H2O NH3↑+ H2O |
| C.稀硝酸和过量的铁屑反应:3 Fe + 8H+ +2 NO3- =" 3" Fe3+ +2 NO↑ + 4 H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ ="2" H2O + I2 |
非金属氧化物采用不同的分类方法可分为不同的类别,从某种意义将N2O5、SO3、CO2、
Cl2O7等归为一类。则下列氧化物与它们属于同一类的是
| A.CO | B.NO2 | C.SO2 | D.NO |
下列化学用语正确的是
A.硫的原子结构示意图: |
B.NH4Cl的电子式:  |
C.原子核内有8个中子的氧原子: |
D.Be2+离子中的质子数和电子数之比为2:1 |