下列离子方程式正确的是
A.钠与水反应: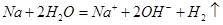 |
B.硅酸钠溶液与醋酸溶液混合: + +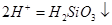 |
C.0.01mol/LNH4Al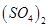 溶液与0.02mol/LBa(OH)2溶液等体积混合: 溶液与0.02mol/LBa(OH)2溶液等体积混合: 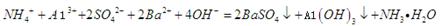 |
D.向次氯酸钙溶液通入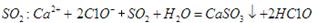 |
下列是4位同学在学习“化学反应速率与化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO2 | D.降低体系温度 |
W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )
| A.W、X、Y形成的简单离子核外电子数相同 |
| B.Z和W可形成原子个数比为1∶2和1∶3的共价化合物 |
| C.Y和Z形成的化合物可以通过复分解反应制得 |
| D.X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应 |
对于常温下pH为2的盐酸,叙述正确的是( )
| A.c(H+)=c(Cl-)+c(OH-) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由H2O电离出的c(H+)=1.0×10-13mol·L-1 |
| D.与等体积0.01 mol·L-1乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-) |
一定体积的N2、O2、CO2混合气体通过足量的Na2O2后,同温同压下体积变为原来的0.75倍,原混合气体中N2、O2、CO2物质的量之比可能为( )
| A.1∶2∶1 | B.4∶3∶5 | C.1∶1∶2 | D.6∶7∶14 |