实验室常用的浓盐酸物质的量浓度约为12.0mol·L-1。
(1)实验室欲用上述浓盐酸配制480mL 0.20mol·L—1的稀盐酸溶液,则需要取上述浓盐酸 mL。
(2)配制过程中,不需要的仪器(填写代号) 。
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
完成实验还缺少的仪器是 、 。
(3)取用任意体积的所配0.20 mol·L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是 (填字母)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl—的数目 D.溶液的密度
某固体混合物可能由Al、(NH4)2SO4、MgCl2 、AlCl3、CuCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体
、AlCl3、CuCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体 体积数据已换算成标准状况下的体积):
体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在CuCl2(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4(填“是”或“否”),你的判断依据是。
⑶写出反应③中的离子方程式
。
(4)请根据计 算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
___________________________________________________________________________。
X、Y、Z为三种常见 的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可)。
的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可)。
(1)当X、Y均为金属时,X的化学式为 ,Z为(填名称)。
(2)当X为非金属且为气体,Y为金属且为紫红色时,X的化学式为 ____,
A的化学式为。
(3)当X为金属、Y为非金属且为固体时,X与A反应的化学方程式 为
为
。
(4)当X、Y均为非金属 固体时,X与A反应的化学方程式为
固体时,X与A反应的化学方程式为
。
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
最高正价和最低负价的绝对值之差为2 |
| B |
最外层电子数是内层电子数的3倍 |
| C |
1molC单质能与 冷水反应,在标准状况下生成11.2LH2 冷水反应,在标准状况下生成11.2LH2 |
| D |
原子最外层电子数等于其周期序数 |
| E |
负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2) D在周期表中的位置为 ________________;
(3)B和C简单离子的半径大小为________ __;(用离子符
__;(用离子符 号和“>”、“=”或“<”表示)
号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
a.比较两种单质的颜色
b.比较氢化物的稳定性
c.依据两元素在周期表中的位置
d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是___________( 写化学式,下同),既含离子键又含共价键的是______________。
写化学式,下同),既含离子键又含共价键的是______________。
材料是人类赖以生存的重要物质基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
(1)①合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架。该合金中含量最高的金属为(填元素符号)。
②铁锈的主要成分是(填化学式),它是钢铁在潮湿的空气中发生腐蚀的结果,其负极反应式为。 ③玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、和(填化学式)。
③玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有CaCO3、和(填化学式)。
(2)聚苯乙烯是造成白色污染的物质之一,其结构简式为 ,则制取聚苯乙烯的单体是。
,则制取聚苯乙烯的单体是。
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段。
(1)①人类的生命活动需要糖类、、维生素、水、和无机盐(或矿物质)等六大素营养物质。
②阿司匹林具有作用。长期大量服用阿司匹林,其水解产物水杨酸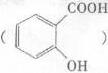 可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:。
可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:。
(2)蛋白质在人体内水解的最终产物是氨基酸。请在下图虚 线方框内写上适当的官能团符号,将氨基酸的通式补充完整:
线方框内写上适当的官能团符号,将氨基酸的通式补充完整: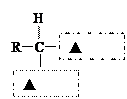
(3)淀粉水解的最终产物是若要检验淀粉的淀粉酶作用下已经发生了水解,可取少量上述溶液加入碱液调到碱性,再加入(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量上述溶液加入几滴溶液,应观察到出现蓝色。