(共12分)下图是一套制取并验证氯气部分化学性质的实验装置。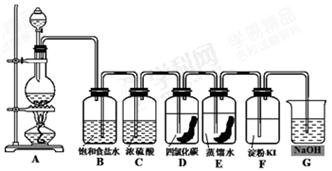
图中,A是Cl2的发生装置,B、C是气体的净化装置,D中盛放浸有有色布条的CCl4溶液,E中盛放浸有有色布条的水溶液,F中盛有淀粉-碘化钾溶液,G烧杯中盛放NaOH溶液。
(1)写出A装置中发生的反应方程式,并用 “ 双线桥法”标出电子的转移方向和数目。
(2)若生成2.8L标准状况时的氯气,被氧化的HCl的物质的量为多少?
(3)上述装置中有一处错误,请指出是 处(用装置字母表示)。
(4)B中饱和食盐水的作用是 ;C中浓硫酸的作用是
(5)有色布条褪色的是 (选择 “D”或“E”或“D、E”),由此可知具有漂白作用的物质是 (填化学式)。F中出现的现象是
(6)G烧杯中NaOH溶液的作用是 ,发生的化学反应方程式: