下列解释实验事实的离子方程式不正确的是
A.Fe与稀H2SO4反应放出气体:Fe + 6H+ 2Fe3+ +3H2↑ 2Fe3+ +3H2↑ |
B.稀H2SO4与BaCl2溶液反应生成沉淀:Ba2+ +SO42- BaSO4↓ BaSO4↓ |
C.用大理石与稀盐酸制备CO2:CaCO3 + 2H+  Ca2+ + CO2↑+ H2O Ca2+ + CO2↑+ H2O |
D.碳酸钠溶液与足量稀盐酸:CO32- + 2H+  CO2↑+ H2O CO2↑+ H2O |
25℃时,水的电离可达到平衡:H2O H++OH—,下列叙述正确的是
H++OH—,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
在一密闭容器中,反应aA(气) bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的40%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的40%,则
| A.平衡向正反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.a< b |
在相同条件下(T=500k),相同体积甲、乙两容器,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2.下列叙述错误的是
| A.化学反应速率乙>甲 | B.平衡后O2浓度乙>甲 |
| C.SO2转化率乙>甲 | D.平衡后SO2的体积分数乙>甲 |
关于中和热测定实验的下列说法不正确的是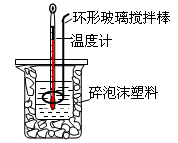
| A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B.使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C.向盛装酸的烧杯中加碱时要小心缓慢 |
| D.测了酸后的温度计要用水清洗后再测碱的温度 |
在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)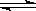 CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
| A.1.2mol | B.1.5mol | C.1.8mol | D.2.5mol |