在密闭容器中进行反应:X2(g)+Y2(g)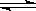 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3 mol·L-1 | B.Y2为0.4 mol·L-1 |
| C.X2为0.2 mol·L-1 | D.Z为0.4 mol·L-1 |
下列各组有机物中,两者的一氯代物的种类不等的是
| A.正戊烷和正已烷 | B.对二甲苯和2-甲基丙烷 |
| C.苯与乙烷 | D.甲苯与2,2-二甲基丙烷 |
由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为
| A.15.6% | B.26.7% | C.30% | D.无法确定 |
最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关羰基硫的说法正确的是
| A.1 mol羰基硫在氧气中完全燃烧时转移8mol电子 |
| B.羰基硫沸点比CO2低 |
| C.羰基硫分子中只有C原子满足八电子结构 |
| D.COS可能与氢气发生加成反应生成HCOSH |
已知:将乙醇和浓硫酸反应的温度控制在140℃,乙醇会发生分子间脱水,并生成乙醚,其反应方程式为2C2H5OH → C2H5-O-C2H5 + H2O。用浓硫酸与分子式分别为C2H6O和C3H8O的醇的混合液反应,可以得到醚的种类有
| A.1 | B.3 | C.5 | D.6 |
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
| A.分子式为C20H24 |
| B.一氯代物的同分异构体只有两种 |
| C.分子中含有二个亚甲基(—CH2—) |
| D.分子中含有12个五元碳环 |