已知:
①N2(g)+O2(g)="==2NO(g)" ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g) 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是
| A.反应②中的能量变化如图所示,则ΔH2=E1-E3 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.氨的催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1 |
| D.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
下列化学用语正确的是
A.乙烯的比例模型: |
B.硫离子的结构示意图: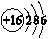 |
| C.质子数为53,中子数为78的碘原子:7853I |
| D.Na2O2的电子式: |
化学与生活密切相关,下列说法不正确的是
| A.水果、蔬菜多属于酸性食物 |
| B.煤中加入适量石灰石可减少SO2的排放 |
| C.青霉素是最重要的抗生素,具有消炎的作用 |
| D.误食重金属盐中毒,可通过喝大量牛奶缓解毒性 |
现有下列物质:①乙炔 ②苯酚溶液 ③乙醛 ④氨基酸。请回答:
(1)能跟溴发生加成反应的是(填序号,下同)。
(2)能跟银氨溶液发生银镜反应的是
(3)能跟饱和溴水反应生成白色沉淀的是
(4)能发生成肽反应的是
某有机物P中碳和氢原子个数比为3∶4,不能与溴水反应却能使酸性KMnO4溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成2种一溴代物。以下说法正确的是
| A.P属于烃的衍生物 |
| B.P可以发生加成反应但不能发生取代反应 |
| C.P中含苯环且有可能两个对位取代基 |
| D.P在光照条件下与溴反应,可以生成3种溴代物 |
下列实验操作中,可达到对应实验目的的是
| 实验操作 |
实验目的 |
|
| A |
苯和溴水混合后加入铁粉 |
制溴苯 |
| B |
某有机物与溴的四氯化碳溶液混合 |
确认该有机物含碳碳双键 |
| C |
乙醇与重铬酸钾(K2Cr2O7)酸性溶液混合 |
乙醇具有还原性 |
| D |
将溴乙烷与氢氧化钠水溶液共热一段时间,冷却,向其中滴加硝酸银溶液 |
检验溴乙烷中的溴原子 |