某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有___________。
(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。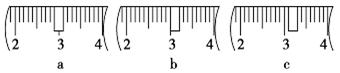
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?________________;理由是_______________________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:________________________________。
实验室现有:未知浓度的烧碱溶液100mL;能随时提供CO2的发生装置; 50mL量筒; 200mL烧杯。请仅利用上述药品和仪器制备较纯净的纯碱溶液。
某学生要用50 mL NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石⑥饱和NaHCO3溶液
实验室有下列仪器:量筒,烧杯,橡皮管,玻璃导管,分液漏斗,烧杯,洗气瓶,酒精灯。
已知下表中各物质在常温时的溶解度(g/100 g H2O)
| Na2CO3 |
NaHCO3 |
NaCl |
Na2SO4 |
NaHSO4 |
NaOH |
| 15.9 |
8.4 |
35 |
35.5 |
20 |
40 |
本实验除了下面图给的仪器外,还应有: (仪器安装补完整)。

实验为保证制得Na2CO3的纯度,应选用的药品,除①外,还应需要: 。
简要叙述实验步骤,直到制得纯碳酸钠溶液 。
根据给出的溶解度表,若保证在配制过程中不会有晶体析出,所用氢氧化钠溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
大气压强对许多物理实验和化学实验有着重要影响。制取氨气并完成喷泉实验。写出实验室制取氨气的化学方程式 。

收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
用左图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
如果只提供如右图的装置,请说明引发喷泉的方法。
根据下图回答问题:
上述装置中,在反应前用手掌贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
写出浓硫酸和木炭粉反应的化学方程式: __________。
如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:A中加入的试剂是 ,作用是 ;B中加入的试剂是 ,作用是 ;C中加入的试剂是 ,作用是除尽 气体;D中加入的试剂是 ,作用是 ;E中加入的试剂是 ,作用是 。
实验时,C中应观察到的现象是 。