对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,X是形成有机物的主要元素,Y元素是日常生活中经常应用的金属,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
| A.原子半径由小到大的顺序:X< Y < Z< W |
| B.Z的最高价氧化物对应的水化物是一种强酸 |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1 |
化学反应中,有时存在物质的量多少不同,反应不同(或物质的浓度或反应温度、催化剂等反应条件不同,反应产物不同)的特殊情况。下列反应中,属于这种情况的是
①锌与18 mol/L的硫酸反应;②浓盐酸与过量的MnO2反应;
③CuSO4溶液与氨水;④过量铜与浓硝酸反应;
⑤Ca(OH)2溶液与NaHCO3溶液混合;⑥乙醇与氧气在一定条件下反应;
⑦甲酸与新制Cu(OH)2悬浊液;⑧苯与液溴在一定条件下发生反应
| A.除②外 | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.使酚酞变红色的溶液:Na+、Ca2+、NO3-、SO42- |
| B.c(OH-)=1×10-13 mol·L-1的溶液:I-、K+、ClO-、SO42- |
| C.使甲基橙变为红色的溶液中:Fe2+、K+、Na+、SO42-、NO3- |
| D.在无色溶液中:MnO4-、Na+、Mg2+、NO3-、SO32-[ |
设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.H2O2溶液中加入MnO2可制得O2,产生2.24L(标况)O2,转移0.4NA个电子 |
B.在52g苯乙烯(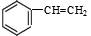 )中含有碳碳双键的个数是2NA )中含有碳碳双键的个数是2NA |
| C.100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA |
| D.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
下列根据化学事实进行的相关推论,正确的是
| 选项 |
化学事实 |
推论 |
| A |
将SO2通入品红溶液中,溶液褪色 |
SO2具有氧化性 |
| B |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色, |
氧化性:H2O2比Fe3+强 |
| C |
取某液体少许与NaOH溶液共热后,再滴加AgNO3溶液,产生白色沉淀 |
卤代烃中的卤原子是Cl原子 |
| D |
向溶液中滴加KSCN,无明显现象,再加氯水,看到溶液变为血红色 |
说明原溶液中含有Fe2+ |