下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是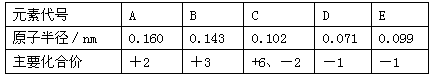
A.A、B的单质与稀盐酸反应速率B>A
B.D、E形成的简单离子的还原性E->D-
C.气态氢化物的稳定性HD<H2C
D.最高价氧化物对应的水化物的酸性 H2CO4>HEO4
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中正确的是()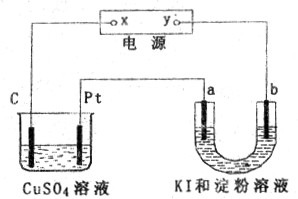
| A.x是负极,y是正极。 |
| B.x是正极,y是负极。 |
| C.a极和Pt产生气体的物质的量相同。 |
| D.CuSO4溶液pH值保持不变,U形管溶液pH值增大。 |
如图,在二个圆底烧瓶中都充满NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:在(1)中加入无水CaCl2,(2)中不加其他任何物质,在(3)中加入NH4Cl晶体。发现: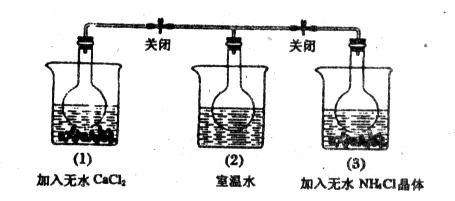
(1)中红综色变深,(3)中红棕色变浅。下列叙述正确的是()
| A.CaCl2溶于水时放出热量 |
| B.烧瓶(1)中气体的压强不变 |
| C.NH4Cl溶于水时放出热量 |
| D.烧瓶(3)中气体的压强增大 |
下列叙述正确的是()
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.常温下,pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.常温下,0.2mol/L的盐酸,稀释至2倍后pH=l |
| D.常温下,pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
下列操作对滴定结果无影响的是()
| A.盛待测液的锥形瓶先用待测液润洗 |
| B.滴定管尖嘴部分有气泡,滴定结束后气泡消失 |
| C.滴定管在滴定前液面在0刻度以下 |
| D.达到滴定终点时俯视读取滴定管内液体体积 |
下列关于沉淀溶解平衡的说法正确的是()
| A.只有难溶电解质才存在沉淀溶解平衡过程 |
| B.沉淀溶解平衡过程是可逆的 |
C.在平衡状态时 |
| D.达到沉淀溶解平衡的溶液不一定是饱和溶液 |