对可逆反应4NH3(g)+5O2(g)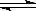 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
25℃、101kPa 下:①2Na(s) +1/2O2(g)=Na2O(s)△H1=-414KJ/mol;
②2Na(s) +O2(g)=Na2O2(s)△H2=-511KJ/mol。
下列说法正确的是()
A.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2N a2O(s)△H=-317kJ/mol a2O(s)△H=-317kJ/mol |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.①和②产物的阴阳离子个数比不相等 |
密闭容器中进行如下反应:N2O4(g)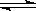 2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是()
2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是()
| A.46 | B.61.3 | C.76.7 | D. 69 |
已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是()
| A.生成物的产量一定增大 | B.生成物的百分含量一定增大 |
| C.反应物的浓度一定降低 | D.每种反应物的转化率一定增大 |
在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数为()
| A.0.34 | B.0.64 | C.0.44 | D.0.54 |
下列叙述正确的是()
| A.强电解质溶液的导电能力一定比弱电解质溶液强 |
| B.因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多 |
| C.物质的量浓度相同的磷酸钠和磷酸溶液中PO43―的物质的量浓度相同 |
| D.足量锌分别和等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,放出H2的速率不等 |