下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
5.0×10-13 |
8.3×10-17 |
A.五种物质在常温下溶解度最大的是Ag2SO4
B.向AgCl的悬浊液中加入0.1mol/L Na2S溶液,则可以生成黑色的Ag2S沉淀
C.外界条件改变时,沉淀溶解平衡也会发生移动
D.常温下,向AgI的悬浊液中加入0.1mol/L NaCl溶液,黄色沉淀变成白色沉淀
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe Sb4O6+6FeS②Sb4O6+6C
Sb4O6+6FeS②Sb4O6+6C 4Sb+6CO↑,关于反应①、②的说法正确的是()
4Sb+6CO↑,关于反应①、②的说法正确的是()
A.反应①②中的氧化剂分别是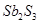 、 、 |
| B.反应②说明高温下C的还原性比Sb强 |
| C.反应①中每生成1mol FeS时,共转移3mol电子 |
| D.每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①过量Na2O2投入到FeCl2溶液中②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中④Na2SiO3溶液中通入过量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2
| A.全部 | B.①⑤ | C.②③④ | D.②③④⑤ |
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质。下列说法错误的是
| A.步骤(1)需要过滤装置 | B.活性物质易溶于有机溶剂,难溶于水 |
| C.步骤(3)需要用到蒸发皿 | D.步骤(4)是利用物质的沸点差异进行分离的 |
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH =CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
| B |
苯酚钠溶液中通入CO2 |
2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
正确 |
| C |
NaHCO3的水解 |
HCO3-+H2O═CO32-+H3O+ |
错误,水解方程式误写成电离方程式 |
| D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是
| A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B.在含I—、SO32—、Br—的溶液中不断通入氯气:I—、Br—、SO32— |
| C.在含Fe3+、H+、NH4+的溶液中逐滴加入烧碱溶液:Fe3+、NH4+、H+ |
| D.在含AlO2—、SO32—、OH—的溶液中逐滴加入硫酸氢钠溶液:OH—、AlO2—、SO32— |