将30 mL 0.5 mol·L―1的NaCl溶液加水稀释到500 mL,稀释后溶液中NaCl的物质的量浓度为
| A.0.03 mol·L―1 | B.0.3 mol·L―1 |
| C.0.05 mol·L―1 | D.0.04 mol·L―1 |
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示(一个小黑点代表一个C60分子),下列说法正确的是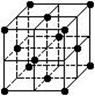
| A.C60摩尔质量是720 |
| B.C60与金刚石都是碳元素形成的单质分子 |
| C.在C60晶胞中有14个C60分子 |
| D.每个C60分子周围与它距离最近等距离的C60分子有12个 |
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是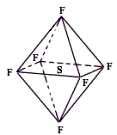
| A.SF6中各原子均达到8电子稳定结构 |
| B.SF6易燃烧生成SO2 |
| C.SF6分子是含有极性键的非极性分子 |
| D.SF6的一氯代物只有一种 |
下列说法正确的是
| A.含有阴离子的晶体中必含有阳离子 |
| B.由极性键构成的AB2型分子必是极性分子 |
| C.非金属元素组成的化合物中只含有共价键 |
| D.离子晶体中必含有离子健,分子晶体中必含有共价键 |
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
| (I) |
(II) |
|
| A |
少量SO2通入Ba(OH)2溶液 |
过量SO2通入少量Ba(OH)2溶液 |
| B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
| C |
0.1mol Cl2通入含0.2mol FeBr2的溶液 |
0.3 molCl2通入1L 0.2 mol•L-1 FeBr2溶液中 |
| D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
下列各选项所述的两个量,前者一定大于后者的是
①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;③NaCl的晶格能与MgO的晶格能;④F元素和O元素的电负性;⑤N和O元素的第一电离能;⑥H原子和H+离子的半径
| A.①④⑤ | B.②④⑥ | C.④⑤⑥ | D.③⑤⑥ |