把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol ·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如下坐标曲线来表示: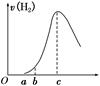
下列推论错误的是
| A.O→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
| B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
| C.c点时反应处平衡状态 |
| D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
下列离子方程式中,属于水解反应的是
A.HCO3-+H2O H3O++CO32- H3O++CO32- |
B.HCO3-+H2O H2CO3+OH- H2CO3+OH- |
C.CO2+H2O HCO3-+H+ HCO3-+H+ |
D.CH3COOH CH3COO-+H+ CH3COO-+H+ |
已知Cu+在酸性条件下能发生下列反应:Cu+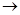 Cu+Cu2+(未配平)。NH4CuS03与足量的lOmol·L-1硫酸溶液混合微热,产生下列现象:
Cu+Cu2+(未配平)。NH4CuS03与足量的lOmol·L-1硫酸溶液混合微热,产生下列现象:
①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。
据此判断下列说法一定合理的是( )
| A.该反应显示硫酸具有酸性 |
| B.NH4CuS03中铜元素全部被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
下列实验操作或事实与预期实验目的或所得结论一致的是( )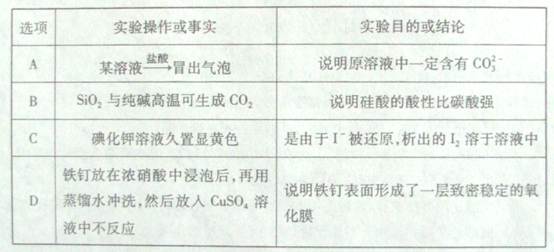
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
A.根据图①可判断可逆反应A2(g)+3B2(g)  2AB3(g)的△H>O 2AB3(g)的△H>O |
B.图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙曲线表示的压强大 3C(g)+D(s)的影响,乙曲线表示的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.室温时,CaC03在水中的沉淀溶解平衡曲线如图④所示,c点时有CaC03生成 |
在容积固定的容器中发生反应:CO(g)+2H2(g) CH3OH(g)△H<0,各物质的浓度如下表
CH3OH(g)△H<0,各物质的浓度如下表
下列说法不正确的是( )
| A.2min-4min内用氢气表示的速率为0.3mol/(L?min) |
| B.达平衡时,CO的转化率为62.5% |
| C.反应在第2min时改变了条件,可能是加入了催化刺 |
| D.反应在第2min时改变了条件,可能增加了H2的浓度 |