相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述正确的是
A.容器①、②中反应达到平衡时所用的时间相等
B.平衡时,两个容器中NH3的体积分数均为12.5%
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.2 L,则平衡时放出的热量>23.15 kJ
反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是()
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是()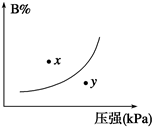
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点比y点时的反应速率慢 ④n>p ⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ | C.只有②③ | D.①③⑤ |
可逆反应mA(g)+nB(g)  pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等⑧右图中阴影部分面积更大,以上说法正确的是()
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等⑧右图中阴影部分面积更大,以上说法正确的是()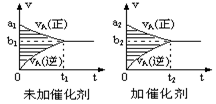
| A.②④⑤⑦ | B.①④⑥⑧ | C.②③⑤⑧ | D.①③⑥⑦ |
在两个恒容容器中有平衡体系:A(g) 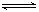 2B(g)和2C(g)
2B(g)和2C(g) 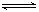 D(g),X1和X2分别是A和C的转化率。在温度不变时分别增加相同物质的量的A和C。下列判断正确的是()
D(g),X1和X2分别是A和C的转化率。在温度不变时分别增加相同物质的量的A和C。下列判断正确的是()
A.X1降低,X2增大 B.X1、X2均降低 C.X1增大,X2降低 D.X1、X2均增大
已知:
CH3 (CH2 )2CH3 ( g )+13/2O2 ( g ) =4CO2 ( g ) + 5 H2O ( l );△H=-2878kJ·mol一1
(CH3)2CHCH3 ( g ) +13/2O2 ( g ) =4CO2 ( g ) + 5 H2O ( l );△H = -2869 kJ·mol一1
下列说法正确的是()
| A.等量的异丁烷分子中碳氢键比正丁烷的多 |
| B.正丁烷分子所具有的能量小于异丁烷分子 |
| C.正丁烷的燃烧热(△H)为一2878kJ·mol一1 |
| D.异丁烷转化为正丁烷的过程是一个放热过程 |
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) 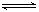 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则()
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则()
A.平衡不移动 B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大 D.再达平衡时,正反应速率增大,逆反应速率减小