某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是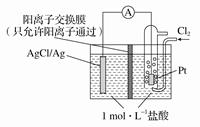
| A.当电路中转移0.1 mol e-时,交换膜左侧溶液中约减少0.2 mol离子 |
| B.放电时,交换膜两侧溶液中均有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.正极反应为AgCl+e-===Ag+Cl- |
下列反应的离子方程式书写不正确的是()
| A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++ SO42- + NH4+= BaSO4↓+ NH3•H2O+H2O |
| B.氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O |
C.硫化钠的水解:S2-+ 2H2O H2S + 2OH- H2S + 2OH- |
| D.NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-= CaCO3↓+2H2O+ CO32- |
固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是()
| A.1molNH5中有5NA个N—H键(NA为阿伏加德罗常数) |
| B.NH5中既有共价键、又有离子键,是离子晶体 |
| C.NH5跟水的反应是氧化还原反应 |
| D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
实验是化学研究的基础,下图装置或操作正确的是()
| A.用装置①量取15.00ml的NaOH溶液 |
| B.用装置②制备Cl2 |
| C.用装置③ 陶瓷坩埚高温煅烧CaCO3固体 |
| D.关闭活塞a,从b处加水,以检查装置④的气密性 |
NA代表阿伏加德罗常数的数值,下列说法正确的是()
| A.1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA |
| B.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA |
| C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA |
| D.t℃时,MgCO3的KSP=4×10-6,,则饱和溶液中含Mg2+数目为2×10-3NA |
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是()
| A.X为SO2气体,也可将SO2换成Na2SO3 |
| B.设备Y为蒸馏塔 |
| C.在提取溴的过程中一定有Br-被氧化 |
| D.工业上每获得1molBr2,需要消耗Cl2的体积最多为22.4L(标准状态下) |