下列离子方程式正确的是
| A.铁和硝酸银溶液反应 Fe+Ag+=3Ag+Fe3+ |
| B.氢氧化镁与硫酸溶液反应 OH-+H+=H2O |
| C.铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
| D.碳酸钙与盐酸反应 CaCO3+2H+= Ca2++CO2↑+H2O |
美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为
| A.47 | B.175 | C.61 | D.57 |
将下图所示实验装置的 K 闭合,下列判断正确的是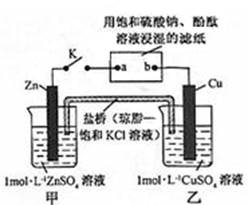
| A.片刻后甲池中c(SO42-)增大 | B.电子沿 Zn→a→b→Cu 路径流动 |
| C.Cu 电极上发生还原反应 | D.片刻后可观察到滤纸a点变红色 |
图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R<W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
下列物质的化学式能表示分子式的是
| A.NaCl | B.SiO2 | C.H2SO4 | D.Cu |
埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是
| A.在潮湿疏松透气的土壤中 | B.在干燥致密不透气的土壤中 |
| C.在含铁元素较多的酸性土壤中 | D.在含碳粒较多,潮湿透气的土壤中 |