某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。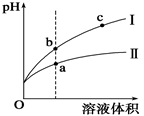
据图判断正确的是
| A.Ⅱ为盐酸稀释时的pH值变化曲线 |
| B.b点酸的总浓度大于a点酸的总浓度 |
| C.a点Kw的数值比c点Kw的数值大 |
| D.b点溶液的导电性比c点溶液的导电性强 |
2015年氰化物成为热议话题。氢氰酸的结构式为H─C ≡ N,则N元素的化合价为
| A.–3 | B.+1 | C.+3 | D.+5 |
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是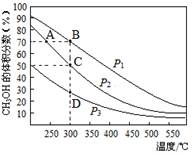
A.该反应的△H<0,且p1<p2
B.反应速率:ν逆(状态A)>ν逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
常温下,下列溶液中微粒的物质的量浓度关系正确的是
| A.将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) |
| B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O) |
| C.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) |
| D.向0.10mol·L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
根据下列实验现象所得结论正确的是
| 选项 |
实验 |
现象 |
结论 |
| A |
取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液 |
溶液未呈蓝色 |
该食盐中不含有碘酸钾 |
| B |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 |
下层溶液显紫红色 |
Fe3+的氧化性大于I2 |
| C |
向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
均有沉淀 |
蛋白质均发生了变性 |
| D |
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 |
白色沉淀逐渐变为蓝色沉淀 |
Ksp[Cu(OH)2]<Ksp [Mg(OH)2] |
青蒿酸是合成青蒿素的原料,可以由香草醛合成:
下列叙述正确的是
| A.青蒿酸分子中含有4个手性碳原子 |
| B.在一定条件,香草醛可与HCHO发生缩聚反应 |
| C.两种物质分别和H2反应,最多消耗H2 4mol和3mol |
| D.可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸 |