由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32-、SO42-。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g。 |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L-1) |
| |
|
| |
|
(3)试确定K+是否存在?________,判断的理由是______________________________
已知下列热化学方程式:
①H2O(l)=H2(g)+1/2O2(g)△H1=+285.8kJ/mol
②H2(g)+1/2O2(g)=H2O(g)△H2=-241.8kJ/mol
③C(s)+1/2O2(g)=CO(g)△H3=-110.5kJ/mol
④C(s)+O2(g)=CO2(g)△H4=-393.5kJ/mol
回答下列问题:
(1)C的燃烧热为
(2)燃烧10gH2生成液态水,放出的热量为
(3)写出CO燃烧的热化学方程式
(4)写出制水煤气的热化学方程式
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。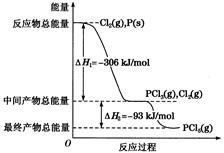
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_______________________
(2)PCl5分解成PCl3和Cl2的热化学方程式是_______________________
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4_____________ΔH3(填“大于”、“小于”或“等于”)。
(1)CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ/mol) |
414.4 |
615.3 |
347.4 |
435.3 |
计算该反应的反应热 (写出计算过程)
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ/mol
试计算1 mol肼和二氧化氮完全反应时放出的热量为__________________kJ,写出肼与二氧化氮反应的热化学方程式:______________________
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: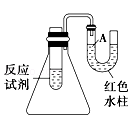
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 ,试管中观察到的现象是
(2)U形导管中液面A (填“上升”或“下降”),原因是 ,说明此反应是 (填“吸热”或“放热”)反应。
将一定量的A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s)  2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
 压强/MPa 压强/MPa 体积分数/% 体积分数/%温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
46.0 |
a |
b |
| 915 |
c |
25.0 |
d |
| 1000 |
e |
f |
15.0 |
回答下列问题:
(1)欲提高C的产率,应采取的措施为 ;
(2)该反应△H 0(填“<”或“>”);
(3)比较K(810℃) K(915℃) (填“<”、“>”或“=”),说明理由 ;
(4)915℃ 2.0MP时A的转化率为 ;
(5)比较b f(填“<”、“>”或“=”),说明理由 ;
(6)若1000℃,3.0MPa时,向容器中加入0.16mol A和0.20mol B,平衡时容器体积为10L,则此时平衡常数K= (保留两位有效数字)。