用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是
| A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ |
| B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1 |
| C.反应①②转移的电子数相同 |
| D.反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol |
下列实验装置设计不能达到目的的是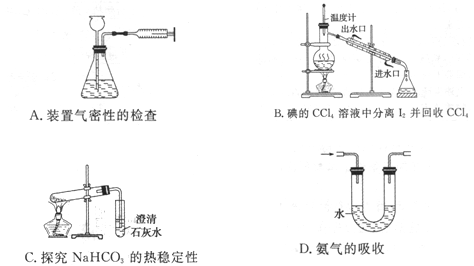
下列各组离子一定能大量共存的是
| A.醋酸溶液中:K+、Cu2+、Na+、C1-、SO2- |
| B.pH=ll的溶液中:HC03-、Na+、NH3.H20、N03- |
| C.常温下,c(H+ )/c(OH-)=10-12的溶液中:NH4+、Fe2+、SO42-、C10- |
| D.在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
下列说法正确的是
| A.将钠投入硫酸铜溶液中只有紫红色固体析出 |
| B.过氧化钠投入硫酸亚铁溶液中出现白色沉淀 |
| C.氨水滴入氯化铝溶液中先出现白色沉淀后溶解 |
| D.饱和氯化钙溶液加入浓氢氧化钠溶液出现白色沉淀 |
设NA代表阿伏加德罗常数。下列有关叙述正确的是
| A.分子数为NA的CO、C2 H4混合气体体积约为22.4 L,质量为28 9 |
| B.常温下,1L0.1mol. L-1的NH。NO。溶液中NH4+和NO3-总数为0.2NA |
| C.标准状况下,4.48 L重水(D2 0)含有的中子数为2 NA |
| D.1 mol甲基(-CH3)所含电子数为9 NA |
下列实验过程中,始终无明显现象的是
| A.NH3通人FeS04溶液中 |
| B.C02通入CaCl2溶液中 |
| C.A1C13溶液中滴入NaHC03溶液 |
| D.S02通入Ba(N03)2溶液中 |