一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+ N(g) xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
下列说法正确的是
| A.反应方程式中的x=1 |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量物质Q |
| D.t1~t3间该反应的平衡常数均为4 |
日常生活中遇到的很多问题都涉及到化学知识,下列有关做法在日常生活中可行的是
| A.医用酒精和工业酒精的主要成分相同,都可用于伤口消毒 |
| B.可利用米汤检验含碘盐的真假 |
| C.低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 |
| D.人体对食物中蛋白质的消化其实就是使蛋白质发生了水解 |
以下化石能源的加工所得产品不符合事实的是
| A.石油分馏—乙炔 | B.石油裂解—乙烯 |
| C.煤的汽化—水煤气 | D.天然气热分解—炭黑 |
下列化学用语正确的是
A.聚丙烯的结构简式: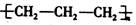 |
B.丙烷分子的比例模型: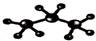 |
C.四氯化碳分子的电子式: |
| D.甲烷结构简式为CH4 |
等物质的量浓度的下列四种溶液中, 浓度最大的是()
浓度最大的是()
| A.NH4Cl | B.NH4HCO3 | C.NH4NO3 | D.NH4HSO4 |
右图是一电池,下列有关说法正确的是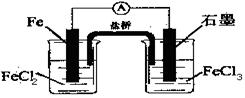
A.该电池负极反应为:2Fe2+-2e- 2Fe3+ 2Fe3+ |
| B.当有6.02×1023电子转移时,Fe电极减少56g |
| C.石墨电极上发生氧化反应 |
| D.盐桥中K+移向FeCl3溶液 |