在酸性溶液中能大量共存,并且溶液为无色透明的是
| A.K+、Ca2+、HCO3-、Cl- |
| B.Cu2+、Na+、NO3-、Cl- |
| C.Na+、K+、Mg2+、SO42- |
| D.Mg2+、Fe3+、Cl-、OH- |
物质的量浓度相同的下列物质的水溶液,碱性最强的是
| A.NaOH | B.NH3·H2O |
| C.Ba(OH)2 | D.Na2CO3 |
下列有机化合物中,属于醇类的是
| A.CH3CH2OH | B.C6H5OH |
| C.CH3COOH | D.CH3COOCH2CH3 |
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物(见下图)的说法正确的是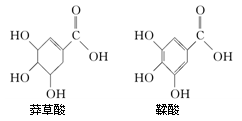
| A.两种酸都能与溴水发生反应 |
| B.鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| C.1mol莽草酸完全燃烧消耗7molO2 |
| D.等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的量相同 |
下列物质不能和溴水发生化学反应而能使酸性高锰酸钾退色的是
| A.C2H5OH | B.苯酚 | C.甲苯 | D.乙醛 |
鼠尾草酚可用于防治骨质疏松,结构如图所示,下列说法正确的是
| A.鼠尾草酚属于芳香烃 |
| B.鼠尾草酚能与FeCl3溶液发生显色反应 |
| C.鼠尾草酚分子式C18H29 O4 |
| D.1mol鼠尾草酚与NaOH溶液反应最多消耗3molNaOH |