下列叙述错误的是:
| A.酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 |
| B.只含有一种元素的物质不一定都是纯净物 |
| C.电离产生H+的化合物叫酸,其分子中氢原子的个数即是该酸的元数 |
| D.压强恒定时,气体在水中的溶解度随温度的升高而降低 |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH—==IO3—+5I—+3H2O
下列说法不正确的是
| A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH— |
| B.电解结束时,右侧溶液中含有IO3— |
| C.电解槽内发生反应的总化学方程式KI+3H2O======KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-Cu2+ |
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是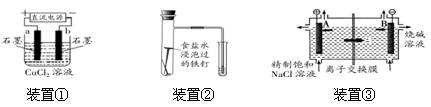
| A.装置①研究的是电解CuCl2溶液,b电极上有红色固体析出 |
| B.装置②研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e- = Fe2+ |
| C.装置③研究的是电解饱和食盐水, B电极发生的反应:2Cl--2e- = Cl2↑ |
| D.三个装置中涉及的主要反应都是氧化还原反应 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l);电解池:2Al + 3H2O Al2O3 + 3H2↑,电解过程中,以下判断正确的是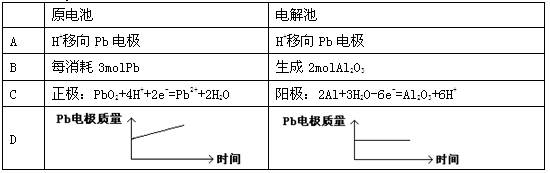
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn - MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |