下列离子方程式书写正确的是
| A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |
| B.氢氧化钡溶液与盐酸反应:OH-+H+ = H2O |
| C.硫酸铜溶液与氢氧化钡溶液混合:Cu2+ + 2 OH-= Cu(OH)2↓ |
| D.钠投入水中:Na +H2O = Na+ + OH- + H2↑ |
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应:Fe2O3+ 3Na2O2 2Na2FeO4 + Na2O,下列说法正确的是
2Na2FeO4 + Na2O,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| C.3 mol Na2O2发生反应,有12 mol电子转移 |
| D.Na2FeO4既是氧化产物又是还原产物 |
下列现象或应用不能用胶体的知识解释的是
| A.可吸入颗粒(如硅酸盐粉尘),吸入人体,对人体健康危害极大 |
| B.土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 |
| C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 |
| D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀 |
下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH +HCO +HCO |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3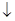 +2HClO +2HClO |
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S |
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO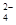 =CaSO4 =CaSO4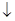 +H2O +H2O |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
| B.6.8g液态KHSO4中含有0.1NA个阳离子 |
| C.标况下的NO2气体22.4L,其中含有的氮原子数为NA |
| D.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
利用下列实验装置进行的相应实验,不能达到实验目的的是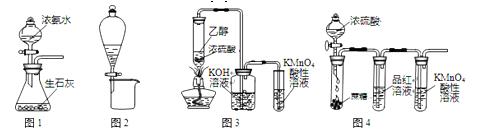
| A.用图1所示装置可制取氨气 |
| B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.用图3所示装置可制取乙烯并验证其易被氧化 |
| D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |