在101 kPa和25℃时,有反应的热化学方程式:
H2(g) + 1/2O2(g) =H2O(g) △H=-241.8kJ/mol,
H2(g) + 1/2O2(g) =H2O(1) △H=-285.8kJ/mol下列说法中错误的是
| A.H2燃烧生成1mol H2O (g)时,放出241.8 kJ的热量 |
| B.H2的燃烧热为-285.8 kJ |
| C.O2前面的1/2表示参加反应的O2的物质的量 |
| D.1 mol液态水变成水蒸气时吸收44 kJ的热量 |
已知两个热化学方程式:C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2 (g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
| A.1︰1 | B.1︰2 | C.2︰3 | D.3︰2 |
容器中如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.X2为0.2mol/L | B.Y2为0.4mol/L |
| C.Z为0.3mol/L | D.Z为0.4mol/L |
在密闭容器中进行下列反应:M (g)+N (g)  R (g)+2 L
R (g)+2 L
此反应符合下图。下列叙述正确的是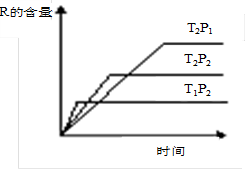
| A.正反应吸热,L是气体 | B.正反应吸热,L是固体 |
| C.正反应放热,L是液体 | D.正反应放热,L是气体 |
合成氨厂所需H2可由焦炭与水反应制得,其中有一步反应为CO(g)+H2O(g)==CO2(g)+H2(g)△H<0欲提高CO转化率,可采用的方法是
①降低温度;②增大压强;③使用催化剂;④增大CO浓度;⑤增大水蒸气浓度
| A.①②③ | B.④⑤ | C.①⑤ | D.⑤ |
一定温度下,密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol。若在开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)=1.2mol | B.若为定容容器,n(NH3)>1.2mol |
| C.若为定压容器,n(NH3) >1.2mol | D.若为定压容器,n(NH3)<1.2mol |