如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是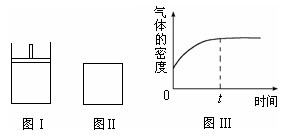
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
热化学方程式中物质前的化学计量数表示
| A.分子数 | B.原子个数 | C.物质的质量 | D.物质的量 |
下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是
| A.已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B—B键、12个硼原子 |
| B.SF6的分子空间构型为正八面体 |
C.1 molHCN分子中有2 mol 键和2mol 键和2mol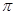 键 键 |
D.32gS8分子中含有0.125 mol 键 键 |
已知铬的价电子排布式为3d54s1,电负性为1.66,I1=652.9KJ/mol,I2=aKJ/mol;锰的价电子排布式为3d54s2,电负性为1.59,I1=717.3KJ/mol,I2=bKJ/mol。下列说法不正确的是
| A.锰、铬都是d区元素 |
| B.锰的未成对电子数比铬的多 |
| C.a>b |
| D.a、b的值取决于铬锰的核外电子排布 |
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断
| A.PH3分子稳定性低于NH3分子,因为N-H键键能高 |
| B.PH3分子中是P是sp3杂化 |
| C.PH3沸点低于NH3沸点,因为P-H键键能低 |
| D.PH3分子呈三角锥形 |
以下有关杂化轨道的说法中错误的是
| A.IA族元素成键时不可能有杂化轨道 |
| B.杂化轨道既可以形成σ键,也可能形成π键 |
| C.孤对电子有可能参加杂化 |
| D.s轨道和p轨道杂化不可能有sp4出现 |