已知:N2(g)+3H2(g) 2NH3(l) △H=" -132" kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H=" -132" kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| |
H2(g) |
N2(g) |
NH3(g) |
| 1mol分子中的化学键形成时要释放出的能量/kJ |
436 |
946 |
a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,
下列说法正确的是
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
酸雨形成的主要原因是
| A.森林乱伐,破坏生态平衡 | B.工业上大量含S燃料燃烧 |
| C.制H2SO4厂排出大量尾气 | D.汽车尾气的排放 |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为()
| A.1∶6 | B.1∶7 | C.2∶11 | D.16∶25 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()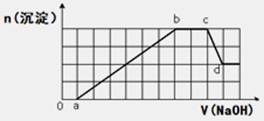
| A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ |
| C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+ |
| D.d点溶液中含有的溶质只有Na2SO4 |
相同物质的量的下列物质:①金属钠②烧碱③过氧化钠④氧化钠,长期放置在空气中(不考虑潮解和水解),质量都会增加,按增加的质量由大到小排列,正确的是()
| A.①>②>④>③ | B.①>②>③>④ |
| C.④>①>③>② | D.④>①>②>③ |
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是()
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |
| B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |