下列说法正确的是
| A.O2的摩尔质量是32 |
| B.摩尔是物质的量的单位 |
C.1 mol任何物质都约含有6.02x10 个原子 个原子 |
D.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4 ( ( 表示阿伏加德罗常数的值) 表示阿伏加德罗常数的值) |
常温时,将下列溶液等体积混合后,所得混合液的pH小于7的是
| A.pH为2的醋酸溶液与pH为12的氢氧化钠溶液 |
| B.0.01 mol·L-1的醋酸溶液与0.01 mol·L-1的氢氧化钠溶液 |
| C.pH为2的硫酸溶液与pH为12的氢氧化钠溶液 |
| D.0.01 mol·L-1的盐酸溶液与0.01 mol·L-1的氢氧化钡溶液 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是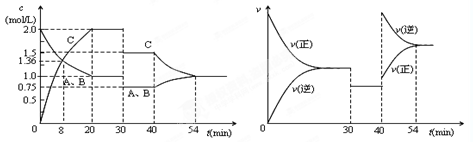
| A.前8min A的平均反应速率为0.08mol/(L·s) |
| B.30min时扩大容器的体积,40min时升高温度 |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.30min和54min的反应的平衡常数相等 |
反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是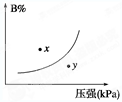
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③n>p ④x点比y点时的反应速率慢 ⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ | C.只有①③ | D.①③⑤ |
常温下,等物质的量浓度、等体积的盐酸分别用pH=9和pH=10的氨水完全中和时,消耗氨水的体积分别为V1和V2,则V1、V2的关系中正确的是
| A.V1=10V2 | B.V1>10V2 | C.V1<10V2 | D.V2>10V1 |
常温下,纯水中存在电离平衡H2O  H++ OH-,若要使水的电离程度增大,并使c(H+)增大,应加入的物质为
H++ OH-,若要使水的电离程度增大,并使c(H+)增大,应加入的物质为
| A.NaHSO4 | B.KAl(SO4)2 | C.NaHCO3 | D.CH3COONa |